Ergänzung 7.2: Fluoreszenz (2/2)
Zustände von Molekülen (Forts.)
Neben der bisher besprochenen elektronischen Anregung treten bei Molekülen zwei weitere Formen der Energieanregung auf:
- Schwingungsanregung. Moleküle können wegen der Massen der beteiligten Atome und der zwischen ihnen wirkenden bindenden Kräfte schwingen. Die dabei auftretenden Schwingungsenergien sind nicht kontinuierlich sondern diskret ('quantisiert'). Sie füllen die Energiemulde um den Gleichgewichtsabstand ro mit zusätzlichen Energiezuständen auf. Die Energiedifferenzen zwischen diesen Zuständen (0,1 eV) sind etwa 10 bis 100 mal kleiner als die Energien, die bei der elektronischen Anregung von Atomen oder Molekülen (1...10 eV) auftreten. Für die Eigenschaften der Molekülfluoreszenz sind - wie weiter unten gezeigt wird - die Schwingungszustände trotzdem sehr wichtig.
- Rotationsanregung. Moleküle können um ihren Schwerpunkt rotieren. Die dabei auftretenden Rotationsenergien (0,01 eV) sind etwa 10 mal kleiner als die Schwingungsenergien.
Fluoreszenz von Molekülen
Bei der Fluoreszenz von Molekülen eines Gases tragen alle genannten Formen der Energieanregung zu den komplexen Strukturen der Fluoreszenzspektren bei. Einfacher sind die Spektren fluoreszierender Flüssigkeiten (zum Beispiel Öle, siehe Seite 2 in Kapitel 7, oder fluoreszierender Moleküle, die in Flüssigkeiten gelöst oder in Partikel gebunden sind (zum Beispiel in Wasser gelöste Gelbstoffe oder das Chlorophyll a in Phytoplankton, siehe Seite 3 in Kapitel 7).
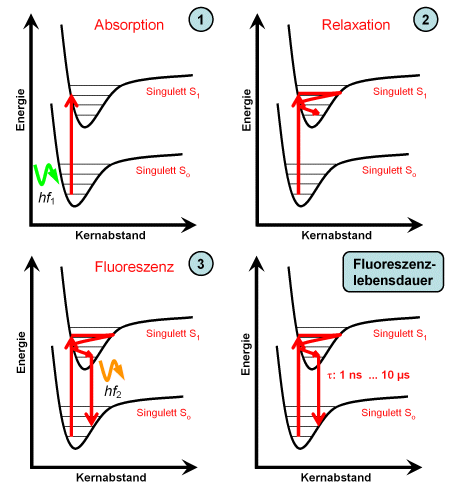
Die Grafik in der linken Spalte zeigt die bei der Fluoreszenz wesentlichen Vorgänge:
- Ein Photon mit der Energie wird absorbiert, das Molekül geht in ein angeregtes Schwingungsniveau des Singulett-Zustands S1 über.
- Vom erreichten Schwingungsniveau ausgehend relaxiert das Molekül in das am tiefsten liegende Schwingungsniveau. Die frei werdende Schwingungsenergie wird als Wärme an die Umgebung abgegeben.
- Vom tiefsten Schwingungsniveau des Singulett-Zustands S1 geht das Molekül in ein Schwingungsniveau des Grundzustands S0 über. Die Energiedifferenz wird als Energie des Fluoreszenzphotons freigesetzt. Wegen der Relaxation ist . Da der Übergang immer vom tiefsten angeregten Schwingungsniveau ausgeht, ist die Energie der Fluoreszenzphotonen (und damit auch die Form des Fluoreszenzspektrums) sehr einheitlich und von der Energie des absorbierten Photons nicht abhängig.
Da beide elektronische Zustände Singuletts sind und der Spin des Elektrons daher erhalten bleibt, geht das Molekül sehr schnell in den Grundzustand über, die Fluoreszenzlebensdauer ist kurz.
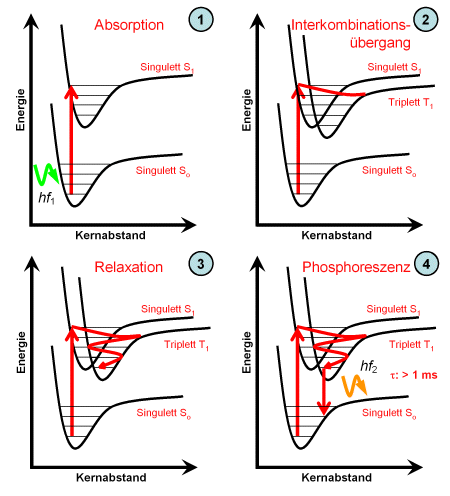
Geht das Molekül im angeregten Zustand vom Singulett in ein Triplett über, dann wird dies als Interkombinationsübergang bezeichnet. Es verbleibt vergleichsweise sehr viel länger in diesem Zustand, bevor es in den Grundzustand zurückkehrt, wie in der unten rechtes gezeigten Grafik dargestellt. Die hierdurch auftretende Phosphoreszenz hat eine lange Lebensdauer.